Química
Soluciones sustancias en botellas de reactivos, incluyendo hidróxido de amonio y ácido nítrico, iluminados de diferentes colores
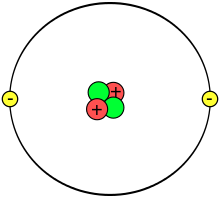
Representación de un átomo de helio en el antiguo modelo atómico de Rutherford.
La química moderna se desarrolló a partir de la alquimia, una práctica protocientífica de carácter filosófico, que combinaba elementos de la química, la metalurgia, la física, la medicina, la biología, entre otras ciencias y artes. Esta fase termina al ocurrir la llamada Revolución de la química, basada en la ley de conservación de la materia y la teoría de la combustión por oxígeno postuladas por el científico francés Antoine Lavoisier.4
Las disciplinas de la química se agrupan según la clase de materia
bajo estudio o el tipo de estudio realizado. Entre éstas se encuentran
la química inorgánica, que estudia la materia inorgánica; la química orgánica, que estudia la materia orgánica; la bioquímica, que estudia las substancias existentes en organismos biológicos; la fisicoquímica que comprende los aspectos energéticos de sistemas químicos a escalas macroscópicas, moleculares y atómicas, y la química analítica, que analiza muestras de materia y trata de entender su composición y estructura.5
Índice
Etimología
La palabra química procede de la palabra «alquimia»,un antiguo conjunto de prácticas protocientíficas que abarcaba diversos
elementos de la actual ciencia, además de otras disciplinas muy
variadas como la metalurgia, la astronomía, la filosofía, el misticismo o la medicina.6
La alquimia, practicada al menos desde alrededor del año 330, además de
buscar la fabricación de oro estudiaba la composición de las aguas, la
naturaleza del movimiento, del crecimiento, de la formación de los
cuerpos y su descomposición, la conexión espiritual entre los cuerpos y
los espíritus.7
Un alquimista solía ser llamado en lenguaje cotidiano «químico», y
posteriormente se denominaría química al arte que practicaba.
A su vez alquimia deriva de la palabra árabe al-kīmīā (الکیمیاء). En origen el término fue un préstamo tomado del griego, de las palabras χημία o χημεία (quemia y quemeia respectivamente).1 8 La primera podría tener origen egipcio. Muchos creen que al-kīmīā deriva de χημία, que a su vez deriva de la palabra Chemi o Kimi, que es el nombre antiguo de Egipto en egipcio.1 La otra alternativa es que al-kīmīā derivara de χημεία, que significa «fusionar».9
Definición
La definición de química ha cambiado a través del tiempo a medida quenuevos descubrimientos se han añadido a la funcionalidad de esta ciencia. El término «química», a vista del reconocido científico Robert Boyle, en 1661, se trataba del área que estudiaba los principios de los cuerpos mezclados.10
En 1663, química se definía como un arte científico por el cual se
aprende a disolver cuerpos, obtener de ellos las diferentes sustancias
de su composición, y como unirlos después para alcanzar un nivel mayor
de perfección. Esto según el químico Christopher Glaser.11
La definición de 1730 para la palabra química, usada por Georg Stahl,
era el arte de entender el funcionamiento de las mezclas, compuestos, o
cuerpos hasta sus principios básicos; y luego volver a componer esos
cuerpos a partir de esos mismos principios.12
En 1837, Jean-Baptiste Dumas, consideró la palabra química para referirse a la ciencia que se preocupaba de las leyes y efectos de las fuerzas moleculares.13
Esta definición luego evolucionaría hasta que, en 1947, se le denominó
la ciencia que se preocupaba de las sustancias: su estructura, sus
propiedades y las reacciones que las transforman en otras substancias
(caracterización dada por Linus Pauling).14
Más recientemente, en 1988, la definición de química fue ampliada
para ser «el estudio de la materia y los cambios que implica», esto, en
palabras del profesor Raymond Chang.15
Introducción
La ubicuidad de la química en las ciencias naturales hace que sea considerada una de las ciencias básicas. La química es de gran importancia en muchos campos del conocimiento, como la ciencia de materiales, la biología, la farmacia, la medicina, la geología, la ingeniería y la astronomía, entre otros.Los procesos naturales estudiados por la química involucran partículas fundamentales (electrones, protones y neutrones), partículas compuestas (núcleos atómicos, átomos y moléculas) o estructuras microscópicas como cristales y superficies.
Desde el punto de vista microscópico, las partículas involucradas en
una reacción química pueden considerarse un sistema cerrado que
intercambia energía con su entorno. En procesos exotérmicos, el sistema libera energía a su entorno, mientras que un proceso endotérmico
solamente puede ocurrir cuando el entorno aporta energía al sistema que
reacciona. En la mayor parte de las reacciones químicas hay flujo de
energía entre el sistema y su campo de influencia, por lo cual puede
extenderse la definición de reacción química e involucrar la energía cinética (calor) como un reactivo o producto.
Aunque hay una gran variedad de ramas de la química, las principales divisiones son:
- Bioquímica,
constituye un pilar fundamental de la biotecnología, y se ha
consolidado como una disciplina esencial para abordar los grandes
problemas y enfermedades actuales y del futuro, tales como el cambio
climático, la escasez de recursos agroalimentarios ante el aumento de
población mundial, el agotamiento de las reservas de combustibles
fósiles, la aparición de nuevas formas de alergias, el aumento
del cáncer, las enfermedades genéticas, la obesidad, etc. - Fisicoquímica,
establece y desarrolla los principios físicos fundamentales detrás de
las propiedades y el comportamiento de los sistemas químicos.16 17 - Química analítica,
(del griego ἀναλύω) es la rama de la química que tiene como finalidad
el estudio de la composición química de un material o muestra, mediante
diferentes métodos de laboratorio. Se divide en química analítica
cuantitativa y química analítica cualitativa. - Química inorgánica,
se encarga del estudio integrado de la formación, composición,
estructura y reacciones químicas de los elementos y compuestos
inorgánicos (por ejemplo, ácido sulfúrico o carbonato cálcico); es
decir, los que no poseen enlaces carbono-hidrógeno, porque éstos
pertenecen al campo de la química orgánica. Dicha separación no es
siempre clara, como por ejemplo en la química organometálica que es una
superposición de ambas. - Química orgánica o química del carbono,
es la rama de la química que estudia una clase numerosa de moléculas
que contienen carbono formando enlaces covalentes carbono-carbono o
carbono-hidrógeno y otros heteroátomos, también conocidos como
compuestos orgánicos. Friedrich Wöhler y Archibald Scott Couper son conocidos como los padres de la química orgánica.
actualidad gran parte del trabajo en química sea de naturaleza
bioquímica. Entre los problemas más interesantes se encuentran, por
ejemplo, el estudio del plegamiento de proteínas y la relación entre secuencia, estructura y función de proteínas.
Si hay una partícula importante y representativa en la química, es el electrón.
Uno de los mayores logros de la química es haber llegado al
entendimiento de la relación entre reactividad química y distribución
electrónica de átomos, moléculas o sólidos. Los químicos han tomado los
principios de la mecánica cuántica
y sus soluciones fundamentales para sistemas de pocos electrones y han
hecho aproximaciones matemáticas para sistemas más complejos. La idea de
orbital atómico y molecular es una forma sistemática en la cual la
formación de enlaces es comprensible y es la sofisticación de los
modelos iniciales de puntos de Lewis. La naturaleza cuántica del
electrón hace que la formación de enlaces sea entendible físicamente y
no se recurra a creencias como las que los químicos utilizaron antes de
la aparición de la mecánica cuántica. Aun así, se obtuvo gran
entendimiento a partir de la idea de puntos de Lewis.
Historia
Las primeras civilizaciones, como los egipcios18y los babilónicos, concentraron un conocimiento práctico en lo que
concierne a las artes relacionadas con la metalurgia, cerámica y tintes,
sin embargo, no desarrollaron teorías complejas sobre sus
observaciones.
Hipótesis básicas emergieron de la antigua Grecia con la teoría de
los cuatro elementos propuesta por Aristóteles. Esta postulaba que el
fuego, aire, tierra y agua, eran los elementos fundamentales por los
cuales todo está formado como mezcla. Los atomicistas griegos datan del
año 440 a. C., en manos de filósofos como Demócrito y Epicuro. En el año 50 antes de Cristo, el filósofo romano Lucrecio, expandió la teoría en su libro De Rerum Natura (En la naturaleza de las cosas)19 20
Al contrario del concepto moderno de atomicismo, esta teoría
primitiva estaba enfocada más en la naturaleza filosófica de la
naturaleza, con un interés menor por las observaciones empíricas y sin
interés por los experimentos químicos.21
En el mundo Helénico, la Alquimia en principio proliferó en
combinación con la magia y el ocultismo como una forma de estudio de las
substancias naturales para transmutarlas en oro y descubrir el elixir
de la eterna juventud.22
La Alquimia fue descubierta y practicada ampliamente en el mundo árabe
después de la conquista de los musulmanes, y desde ahí, fue
difuminándose hacia todo el mundo medieval y la Europa Renacentista a
través de las traducciones latinas.23
Química como ciencia
Bajo la influencia de los nuevos métodos empíricos propuestos por sir Francis Bacon, Robert Boyle, Robert Hooke, John Mayow,entre otros, comenzaron a remodelarse las viejas tradiciones
acientíficas en una disciplina científica. Boyle, en particular, es
considerado como el padre fundador de la química debido a su trabajo más
importante, «El Químico Escéptico» donde se hace la diferenciación
entre las pretensiones subjetivas de la alquimia y los descubrimientos
científicos empíricos de la nueva química.24 Él formuló la ley de Boyle,
rechazó los «cuatro elementos» y propuso una alternativa mecánica de
los átomos y las reacciones químicas las cuales podrían ser objeto de
experimentación rigurosa, demostrándose o siendo rebatidas de manera
científica.25
La teoría del flogisto (una substancia que, suponían, producía toda combustión) fue propuesta por el alemán Georg Ernst Stahl en el siglo XVIII y solo fue rebatida hacia finales de siglo por el químico francés Antoine Lavoisier,
quien dilucidó el principio de conservación de la masa y desarrolló un
nuevo sistema de nomenclatura química utilizada para el día de hoy.26
Antes del trabajo de Lavoisier, sin embargo, se han hecho muchos
descubrimientos importantes, particularmente en lo que se refiere a lo
relacionado con la naturaleza de "aire", que se descubrió, que se
compone de muchos gases diferentes. El químico escocés Joseph Black (el primer químico experimental) y el holandés J. B. van Helmont descubrieron dióxido de carbono, o lo que Black llamaba "aire fijo" en 1754; Henry Cavendish descubre el hidrógeno y dilucida sus propiedades. Finalmente, Joseph Priestley e, independientemente, Carl Wilhelm Scheele aíslan oxígeno puro.
El científico inglés John Dalton propone en 1803 la teoría moderna de los átomos en su libro, La teoría atómica,
donde postula que todas las substancias están compuestas de "átomos"
indivisibles de la materia y que los diferentes átomos tienen diferentes
pesos atómicos.
El desarrollo de la teoría electroquímica de combinaciones químicas
se produjo a principios del siglo XIX como el resultado del trabajo de
dos científicos en particular, J. J. Berzelius y Humphry Davy,
gracias a la invención, no hace mucho, de la pila voltaica por
Alessandro Volta. Davy descubrió nueve elementos nuevos, incluyendo los
metales alcalinos mediante la extracción de ellos a partir de sus óxidos
con corriente eléctrica.27
El británico William Prout
propuso el ordenar a todos los elementos por su peso atómico, ya que
todos los átomos tenían un peso que era un múltiplo exacto del peso
atómico del hidrógeno. J. A. R. Newlands ideó una primitiva tabla de los elementos, que luego se convirtió en la tabla periódica moderna creada por el alemán Julius Lothar Meyer y el ruso Dmitri Mendeleev en 1860.28
Los gases inertes, más tarde llamados gases nobles, fueron descubiertos
por William Ramsay en colaboración con lord Rayleigh al final del
siglo, llenando por lo tanto la estructura básica de la tabla.
La química orgánica ha sido desarrollada por Justus von Liebig y otros luego de que Friedrich Wohler sintetizara urea, demostrando que los organismos vivos eran, en teoría, reducibles a terminología química29
Otros avances cruciales del siglo XIX fueron: la comprensión de los
enlaces de valencia (Edward Frankland,1852) y la aplicación de la
termodinámica a la química (J. W. Gibbs y Svante Arrhenius, 1870).
Estructura química
Llegado el siglo XX los fundamentos teóricos de la química fueronfinalmente entendidos debido a una serie de descubrimientos que tuvieron
éxito en comprobar la naturaleza de la estructura interna de los
átomos. En 1897, J. J. Thomson, de la Universidad de Cambridge,
descubrió el electrón y poco después el científico francés Becquerel,
así como la pareja de Pierre y Marie Curie investigó el fenómeno de la
radiactividad. En una serie de experimentos de dispersión, Ernest
Rutherford, en la Universidad de Mánchester, descubrió la estructura
interna del átomo y la existencia del protón, clasificando y explicando
los diferentes tipos de radiactividad, y con éxito, transmuta el primer
elemento mediante el bombardeo de nitrógeno con partículas alfa.
El trabajo de Rutheford en la estructura atómica fue mejorado por sus
estudiantes, Niels Bohr y Henry Mosley. La teoría electrónica de los
enlaces químicos y orbitales moleculares fue desarrollada por los
científicos americanos Linus Pauling y Gilbert N. Lewis.
El año 2011 fue declarado por las Naciones Unidas como el Año Internacional de la Química.30
Esta iniciativa fue impulsada por la Unión Internacional de Química
Pura y Aplicada, en conjunto con la Organización de las Naciones Unidas
para la Educación, la Ciencia y la Cultura. Se celebró por medio de las
distintas sociedades de químicos, académicos e instituciones de todo el
mundo y se basó en iniciativas individuales para organizar actividades
locales y regionales.
Principios de la química moderna
El actual modelo de la estructura atómica es el modelo mecánico cuántico.31 La química tradicional comenzó con el estudio de las partículas elementales: átomos, moléculas,32sustancias, metales, cristales y otros agregados de la materia. La
materia podía ser estudiada en estados líquido, de gas o sólidos, ya sea
de manera aislada o en combinación. Las interacciones, reacciones y
transformaciones que se estudian en química son generalmente el
resultado de las interacciones entre átomos, dando lugar a
recordenamientos de los enlaces químicos que los mantienen unidos a
otros átomos. Tales comportamientos son estudiados en un laboratorio de
química.
En el laboratorio de química se suelen utilizar diversos útiles de
cristalería. Sin embargo, la cristalería no es fundamental en la
experimentación química ya que gran cantidad de experimentación
científica (así sea en química aplicada o industrial) se realiza sin
ella.
Una reacción química es la transformación de algunas sustancias en una o más sustancias diferentes.33
La base de tal transformación química es la reordenación de los
electrones en los enlaces químicos entre los átomos. Se puede
representar simbólicamente como una ecuación química, que por lo general
implica átomos como la partícula central. El número de átomos a la
izquierda y la derecha en la ecuación para una transformación química
debe ser igual (cuando es desigual, la transformación, por definición,
no es química, sino más bien una reacción nuclear o la desintegración
radiactiva). El tipo de reacciones químicas que una sustancia puede
experimentar y los cambios de energía que pueden acompañarla, son
determinados por ciertas reglas básicas, conocidas como leyes químicas.
Las consideraciones energéticas y de entropía son variables
importantes en casi todos los estudios químicos. Las sustancias químicas
se clasifican sobre la base de su estructura, estado y composiciones
químicas. Estas pueden ser analizadas usando herramientas del análisis
químico, como por ejemplo, la espectroscopia y cromatografía. Los
científicos dedicados a la investigación química se les suele llamar
«químicos».34
La mayoría de los químicos se especializan en una o más áreas
subdisciplinas. Varios conceptos son esenciales para el estudio de la
química, y algunos de ellos son:35
Materia
En química, la materia se define como cualquier cosa que tenga masaen reposo, volumen y se componga de partículas. Las partículas que
componen la materia también poseen masa en reposo, sin embargo, no todas
las partículas tienen masa en reposo, un ejemplo es el fotón. La
materia puede ser una sustancia química pura o una mezcla de sustancias.36
Átomos
El átomo es la unidad básica de la química. Se compone de un núcleodenso llamado núcleo atómico, el cual es rodeado por un espacio
denominado «nube de electrones». El núcleo se compone de protones
cargados positivamente y neutrones sin carga (ambos denominados
nucleones). La nube de electrones son electrones que giran alrededor del
núcleo cargados negativamente.
En un átomo neutro, los electrones cargados negativamente equilibran
la carga positiva de los protones. El núcleo es denso; La masa de un
nucleón es 1836 veces mayor que la de un electrón, sin embargo, el radio
de un átomo es aproximadamente 10 000 veces mayor que la de su núcleo37 38
El átomo es la entidad más pequeña que se debe considerar para
conservar las propiedades químicas del elemento, tales como la
electronegatividad, el potencial de ionización, los estados de oxidación
preferidos, los números de coordinación y los tipos de enlaces que un
átomo prefiere formar (metálicos, iónicos, covalentes, etc.).
Elemento
Un elemento químico es una sustancia pura que se compone de un solotipo de átomo, caracterizado por su número particular de protones en los
núcleos de sus átomos, número conocido como «número atómico» y que es
representado por el símbolo Z. El número másico es la suma del número de
protones y neutrones en el núcleo. Aunque todos los núcleos de todos
los átomos que pertenecen a un elemento tengan el mismo número atómico,
no necesariamente deben tener el mismo número másico; átomos de un
elemento que tienen diferentes números de masa se conocen como isótopos.
Por ejemplo, todos los átomos con 6 protones en sus núcleos son átomos
de carbono, pero los átomos de carbono pueden tener números másicos de
12 o 13.39
La presentación estándar de los elementos químicos está en la tabla
periódica, la cual ordena los elementos por número atómico. La tabla
periódica se organiza en grupos (también llamados columnas) y períodos
(o filas). La tabla periódica es útil para identificar tendencias
periódicas.40
Compuesto
Un compuesto es una sustancia química pura compuesta de más de unelemento. Las propiedades de un compuesto tienen poca similitud con las
de sus elementos.41 La nomenclatura estándar de los compuestos es fijado por la Unión Internacional de Química Pura y Aplicada (IUPAC). Los compuestos orgánicos se nombran según el sistema de nomenclatura orgánica.42 Los compuestos inorgánicos se nombran según el sistema de nomenclatura inorgánica.43
Además, el Servicio de Resúmenes Químicos ha ideado un método para
nombrar sustancias químicas. En este esquema cada sustancia química es
identificable por un número conocido como número de registro CAS.
Subdisciplinas de la química
Instituto de Tecnología Química Inorgánica e Ingeniería Ambiental,
Instituto de Polímeros y Instituto de Tecnología Química Orgánica, Universidad Tecnológica de Pomerania Occidental, en Szczecin, Polonia.
Instituto de Polímeros y Instituto de Tecnología Química Orgánica, Universidad Tecnológica de Pomerania Occidental, en Szczecin, Polonia.
la práctica se estudia cada tema de manera particular. Las seis
principales y más estudiadas ramas de la química son:
- Química inorgánica: síntesis y estudio de las propiedades eléctricas, magnéticas y ópticas de los compuestos formados por átomos que no sean de carbono
(aunque con algunas excepciones). Trata especialmente los nuevos
compuestos con metales de transición, los ácidos y las bases, entre
otros compuestos. - Química orgánica: Síntesis y estudio de los compuestos que se basan en cadenas de carbono.
- Bioquímica:
estudia las reacciones químicas en los seres vivos, estudia el
organismo y los seres vivos. Bioquímica es el estudio de las sustancias
químicas, las reacciones químicas y las interacciones químicas que
tienen lugar en los organismos vivos. Bioquímica y la química orgánica
están estrechamente relacionados, como en la química médica o
neuroquímica. Bioquímica también se asocia con la biología molecular y
la genética. - Química física:
también conocidas como fisicoquímica, estudia los fundamentos y bases
físicas de los sistemas y procesos químicos. En particular, son de
interés para el químico físico los aspectos energéticos y dinámicos de
tales sistemas y procesos. Entre sus áreas de estudio más importantes se
incluyen la termodinámica química, la cinética química, la electroquímica, la mecánica estadística y la espectroscopia. Usualmente se la asocia también con la química cuántica y la química teórica. - Química industrial:
Estudia los métodos de producción de reactivos químicos en cantidades
elevadas, de la manera económicamente más beneficiosa. En la actualidad
también intenta aunar sus intereses iníciales, con un bajo daño al medio ambiente. - Química analítica: estudia los métodos de detección (identificación) y cuantificación (determinación) de una sustancia en una muestra. Se subdivide en Cuantitativa y Cualitativa.[cita requerida]
tienen una historia y, por ende, en su estructura nos hablan de su
historia, del pasado en el que se han constituido, mientras que una
molécula orgánica, creada hoy, es solo testigo de su presente, sin
pasado y sin evolución histórica.44
Además existen múltiples subdisciplinas que, por ser demasiado
específicas o bien multidisciplinares, se estudian individualmente:[cita requerida]
- astroquímica
es la ciencia que se ocupa del estudio de la composición química de los
astros y el material difuso encontrado en el espacio interestelar,
normalmente concentrado en grandes nubes moleculares. - electroquímica es una rama de la química que estudia la transformación entre la energía eléctrica y la energía química.
- fotoquímica,
una subdisciplina de la química, es el estudio de las interacciones
entre átomos, moléculas pequeñas, y la luz (o radiación
electromagnética). - magnetoquímica es la rama de la química que se dedica a la síntesis y el estudio de las sustancias de propiedades magnéticas interesantes.
- nanoquímica (relacionada con la nanotecnología).
- petroquímica
es lo perteneciente o relativo a la industria que utiliza el petróleo o
el gas natural como materias primas para la obtención de productos
químicos. - geoquímica: estudia todas las transformaciones de los minerales existentes en la tierra.
- química computacional
es una rama de la química que utiliza computadores para ayudar a
resolver problemas químicos. Utiliza los resultados de la química
teórica, incorporados en algún software para calcular las estructuras y
las propiedades de moléculas y cuerpos sólidos. Mientras sus resultados
normalmente complementan la información obtenida en experimentos
químicos, pueden, en algunos casos, predecir fenómenos químicos no
observados a la fecha. - química cuántica es una rama de la química teórica en donde se aplica la mecánica cuántica y la teoría cuántica de campos.
- química macromolecular: estudia la preparación, caracterización, propiedades y aplicaciones de las macromoléculas o polímeros;
- química medioambiental: estudia la influencia de todos los componentes químicos que hay en la tierra, tanto en su forma natural como antropogénica;
- química nuclear o física nuclear es una rama de la física que estudia las propiedades y el comportamiento de los núcleos atómicos.
- química organometálica
se encarga del estudio de los compuestos organometálicos, que son
aquellos compuestos químicos que poseen un enlace entre un átomo de
carbono y un átomo metálico, de su síntesis y de su reactividad. - química supramolecular es la rama de la química que estudia las interacciones supramoleculares, esto es, entre moléculas.
- química teórica incluye el uso de la física para explicar o predecir fenómenos químicos.
Los aportes de célebres autores
Hace aproximadamente 455 años solo se conocían doce elementos. Amedida que fueron descubriendo más elementos, los científicos se dieron
cuenta de que todos guardaban un orden preciso. Cuando los colocaron en
una tabla ordenada en filas y columnas, vieron que los elementos de una
misma columna tenían propiedades similares. Pero también aparecían
espacios vacíos en la tabla para los elementos aún desconocidos. Estos
espacios huecos llevaron al científico ruso Dmitri Mendeléyve a pronosticar la existencia del germanio,
de número atómico 32, así como su color, su peso, su densidad y su
punto de fusión. Su “predicción sobre otros elementos como —el galio y el escandio— también resultó muy atinada”, señala la obra Chemistry, libro de texto de química editado en 1995.45
Campo de trabajo: el átomo
El origen de la teoría atómica se remonta a la escuela filosófica de los atomistas, en la Grecia antigua. Los fundamentos empíricos de la teoría atómica, de acuerdo con el método científico, se debe a un conjunto de trabajos hechos por Antoine Lavoisier, Louis Proust, Jeremias Benjamin Richter, John Dalton, Gay-Lussac, Berzelius y Amadeo Avogadro entre muchos otros, hacia principios del siglo XIX.Los átomos
son la fracción más pequeña de materia estudiados por la química, están
constituidos por diferentes partículas, cargadas eléctricamente, los electrones, de carga negativa; los protones, de carga positiva; los neutrones, que, como su nombre indica, son neutros (sin carga); todos ellos aportan masa para contribuir al peso.
Conceptos fundamentales
Partículas
Los átomos son las partes más pequeñas de un elemento (como el carbono, el hierro o el oxígeno).Todos los átomos de un mismo elemento tienen la misma estructura
electrónica (responsable ésta de la mayor parte de las características
químicas), y pueden diferir en la cantidad de neutrones (isótopos). Las moléculas son las partes más pequeñas de una sustancia (como el azúcar), y se componen de átomos enlazados entre sí. Si tienen carga eléctrica, tanto átomos como moléculas se llaman iones: cationes si son positivos, aniones si son negativos.
El mol se usa como contador de unidades, como la docena (12) o el millar (1000), y equivale a
 . Se dice que 12 gramos de carbono o un gramo de hidrógeno o 56 gramos de hierro contienen aproximadamente un mol de átomos (la masa molar
. Se dice que 12 gramos de carbono o un gramo de hidrógeno o 56 gramos de hierro contienen aproximadamente un mol de átomos (la masa molarde un elemento está basada en la masa de un mol de dicho elemento). Se
dice entonces que el mol es una unidad de cambio. El mol tiene relación
directa con el número de Avogadro. El número de Avogadro fue estimado para el átomo de carbono por el químico y físico italiano Carlo Amedeo Avogadro,
Conde de Quarequa e di Cerreto. Este valor, expuesto anteriormente,
equivale al número de partículas presentes en 1 mol de dicha sustancia:
1 mol de glucosa equivale a
 moléculas de glucosa. 1 mol de uranio equivale a
moléculas de glucosa. 1 mol de uranio equivale a  átomos de uranio.
átomos de uranio.Dentro de los átomos puede existir un núcleo atómico y uno o más electrones.
Los electrones son muy importantes para las propiedades y las
reacciones químicas. Dentro del núcleo se encuentran los neutrones y los
protones. Los electrones se encuentran alrededor del núcleo. También se
dice que el átomo es la unidad básica de la materia con características
propias. Está formado por un núcleo, donde se encuentran los protones.
De los átomos a las moléculas
Los enlacesson las uniones entre átomos para formar moléculas. Siempre que existe
una molécula es porque ésta es más estable que los átomos que la forman
por separado. A la diferencia de energía entre estos dos estados se le denomina energía de enlace.
Los átomos se combinan en proporciones fijas para generar moléculas concretas. Por ejemplo, dos átomos de hidrógeno se combinan con uno de oxígeno para dar una molécula de agua. Esta proporción fija se conoce como estequiometría. Sin embargo, el mismo número y tipo de átomos puede combinarse de diferente forma dando lugar a sustancias isómeras.46
Orbitales
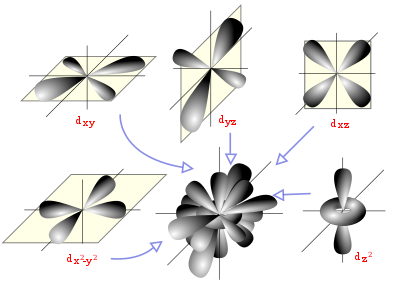
Diagrama espacial que muestra los orbitales atómicos hidrogenoides de momento angular del tipo d (l=2).
químicas y de las propiedades físicas de las diferentes sustancias, es
muy útil su descripción a través de orbitales, con ayuda de la química cuántica.
Un orbital atómico es una función matemática que describe la disposición de uno o dos electrones en un átomo. Un orbital molecular es el análogo en las moléculas.
En la teoría del orbital molecular la formación del enlace covalente se debe a una combinación matemática de orbitales atómicos (funciones de onda)
que forman orbitales moleculares, llamados así porque pertenecen a toda
la molécula y no a un átomo individual. Así como un orbital atómico
(sea híbrido o no) describe una región del espacio que rodea a un átomo
donde es probable que se encuentre un electrón, un orbital molecular
describe también una región del espacio en una molécula donde es más
factible que se hallen los electrones.
Al igual que un orbital atómico, un orbital molecular tiene un
tamaño, una forma y una energía específicos. Por ejemplo, en la molécula
de hidrógeno molecular se combinan dos orbitales atómicos, ocupado cada
uno por un electrón. Hay dos formas en que puede presentarse la
combinación de orbitales: aditiva y substractiva. La combinación aditiva
produce la formación de un orbital molecular que tiene menor energía y
que presenta una forma casi ovalada, mientras que la combinación
substractiva conduce a la formación de un orbital molecular con mayor
energía y que genera un nodo entre los núcleos.
De los orbitales a las sustancias
Los orbitales son funciones matemáticas para describir procesosfísicos: un orbital únicamente existe en el sentido matemático, como
pueden existir una suma, una parábola o una raíz cuadrada. Los átomos y las moléculas son también idealizaciones y simplificaciones: un átomo y una molécula solo existen en el vacío, y en sentido estricto una molécula solo se descompone en átomos si se rompen todos sus enlaces.
En el "mundo real" únicamente existen los materiales y las sustancias. Si se confunden los objetos reales con los modelos teóricos que se usan para describirlos, es fácil caer en falacias lógicas.
Disoluciones
En agua, y en otros disolventes (como la acetona o el alcohol), es posible disolver sustancias, de forma que quedan disgregadas en las moléculas o en los iones que las componen (las disoluciones son transparentes). Cuando se supera cierto límite, llamado solubilidad, la sustancia ya no se disuelve, y queda, bien como precipitado en el fondo del recipiente, bien como suspensión, flotando en pequeñas partículas (las suspensiones son opacas o traslúcidas).Se denomina concentración a la medida de la cantidad de soluto por unidad de cantidad de disolvente.
Medida de la concentración
La concentración de una disolución se puede expresar de diferentesformas, en función de la unidad empleada para determinar las cantidades
de soluto y disolvente. Las más usuales son:
- g/l (gramos por litro) razón soluto/disolvente o soluto/disolución, dependiendo de la convención
- % p/p (concentración porcentual en peso) razón soluto/disolución
- % V/V (concentración porcentual en volumen) razón soluto/disolución
- M (molaridad) razón soluto/disolución
- N (normalidad) razón soluto/disolución
- m (molalidad) razón soluto/disolvente
- x (fracción molar)
- ppm (partes por millón) razón soluto/disolución
Acidez
El pH es una escala logarítmica para describir la acidez de una disolución acuosa. Los ácidos, como por ejemplo el zumo de limón y el vinagre, tienen un pH bajo (inferior a 7). Las bases, como la sosa o el bicarbonato de sodio, tienen un pH alto (superior a 7).El pH se calcula mediante la siguiente ecuación:
 es la actividad de iones hidrógeno en la solución, la que en soluciones diluidas es numéricamente igual a la molaridad de iones hidrógeno
es la actividad de iones hidrógeno en la solución, la que en soluciones diluidas es numéricamente igual a la molaridad de iones hidrógeno ![[H^+]\,](https://wikimedia.org/api/rest_v1/media/math/render/svg/7791752d16c72c1ea7d8dfcbbec110f62cc22e8d) que cede el ácido a la solución.
que cede el ácido a la solución.- una solución neutral (agua ultra pura) tiene un pH de 7, lo que implica una concentración de iones hidrógeno de 10-7 M;
- una solución ácida (por ejemplo, de ácido sulfúrico)tiene un pH < 7, es decir, la concentración de iones hidrógeno es mayor que 10-7 M;
- una solución básica (por ejemplo, de hidróxido de potasio) tiene un pH > 7, o sea que la concentración de iones hidrógeno es menor que 10-7 M.
Formulación y nomenclatura
La IUPAC, un organismo internacional, mantiene unas reglas para la formulación y nomenclatura química. De esta forma, es posible referirse a los compuestos químicos de forma sistemática y sin equívocos.Mediante el uso de fórmulas químicas es posible también expresar de forma sistemática las reacciones químicas, en forma de ecuación química.
Por ejemplo:
Véase también
 Portal:Química. Contenido relacionado con Química.
Portal:Química. Contenido relacionado con Química.
- Absorción
- Biología
- Catalizador
- Dinámica molecular
- Farmacia
- Filosofía de la química
- Física
- IUPAC
- Lista de compuestos
- Matemáticas
- Propiedades periódicas
- Química (etimología)
- Sustancia química
- Tabla periódica de los elementos
- Comparación de la química y la física
Referencias
Bibliografía
- Atkins, Peter; de Paula, Julio (2009). Elements of Physical Chemistry (en inglés) (quinta edición). Nueva York: Oxford University Press. ISBN 978-0-19-922672-6.
- Burrows, Andrew; Holman, John; Burrows, John; Parsons, Andrew; Pilling, Gwen; Price, Gareth (2009). Chemistry 3. Italia: Oxford University Press. ISBN 978-0-19-927789-6.
- Housecroft, Catherine E.; Sharpe, Alan G. (2008). Inorganic Chemistry (tercera edición). Harlow, Essex: Pearson Education. ISBN 978-0-13-175553-6.
Enlaces externos
 Wikcionario tiene definiciones y otra información sobre química.
Wikcionario tiene definiciones y otra información sobre química. Wikiquote alberga frases célebres de o sobre Química.
Wikiquote alberga frases célebres de o sobre Química.  Wikimedia Commons alberga contenido multimedia sobre Química.
Wikimedia Commons alberga contenido multimedia sobre Química.
 Wikilibros alberga un libro o manual sobre Química.
Wikilibros alberga un libro o manual sobre Química. Wikinoticias tiene noticias relacionadas con Química.
Wikinoticias tiene noticias relacionadas con Química. Wikiversidad alberga proyectos de aprendizaje sobre Química.
Wikiversidad alberga proyectos de aprendizaje sobre Química.- Instituto Catalán de Investigación Química (ICIQ)
- Libros antiguos de ciencia
Otros proyectos
(50 BCE). "de Rerum Natura (On the Nature of Things)". The Internet
Classics Archive. Massachusetts Institute of Technology. Retrieved
2007-01-09.
Humphry (1808). "On some new Phenomena of Chemical Changes produced by
Electricity, particularly the Decomposition of the fixed Alkalies, and
the Exhibition of the new Substances, which constitute their Bases". Philosophical Transactions of the Royal Society (Royal Society of London.) 98 (0): 1-45. doi:10.1098/rstl.1808.0001.




![pH= -\log a_{H^+} \approx -\log [H^+]\,](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d4d64ba7738f32b91c6cc4134c3dfb0f9c84bc9)

No hay comentarios:
Publicar un comentario